|
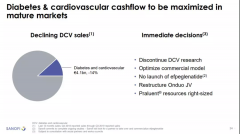
全球超过25个研究中心证实了CAR-T在治疗白血病、淋巴瘤等疾病上的“实力”。例如第一款获批上市的CAR-T 但作为新型细胞疗法的“顶级流量”,CAR-T实际上在近几年才被改良使用到临床上。其基本原理,就是利用病人自身的免疫细胞来清除癌细胞,属于细胞疗法。医学界认为,未来细胞治疗产品有望成为超越单抗的新一代活体药物。目前,CAR-T疗法在急性白血病和非霍奇金淋巴瘤的治疗上有着显著疗效,被认为是最有前景的肿瘤治疗方式之一。 2012年,曾与宾夕法尼亚大学签订协议,获得在全球范围许可,开展CAR-T细胞治疗的平台建设。5年后的2017年8月,其协议的主导项目Kymriah tisagenlecleucel获批上市,这是CAR-T疗法在世界范围内第一个获准上市的产品。 然而可惜的是,在实体肿瘤治疗领域,CAR-T疗法虽然被很多人视为必需的治疗手段,其疗效却始终不尽人意。作为在技术上处于领先地位的头部企业,诺华此次官宣放弃,行业内外一片哗然。但也并未解释此举的具体原因。 诺华制药CEO Vas Narasimhan说:“自体CAR-T细胞疗法目前仍是血癌治疗领域的优先治疗手段。” 诺华制药也表示,公司还会通过合作伙伴继续推进该疗法的开发,并计划通过内部人才来解决第一代产品存在的问题。 而在全球范围内,企业和科学家仍在扩充CAR-T疗法的适应症范围、规避其毒副作用,并在标准化和规模化等方面不断投入,但CAR-T疗法的投资热情已下降不少。 2017年9月1日,诺华宣布FDA正式批准其突破性的CAR-T疗法药物Kymriah tisagenlecleucel上市(曾用名CTL019),用于治疗25岁以下难治复发性B细胞前体急性淋巴性白血病(ALL)患者,定价47.5万美元。FDA在新闻公告中明确将CAR-T疗法Kymriah划分为以细胞工程为基础的基因治疗产品。 根据其首次公布的CAR-T细胞制备全过程,Kymriah是一款通过基因改造自体T细胞、再引导其锁定和消灭癌细胞的免疫疗法。首先从个体患者体内提取出免疫T细胞,在生产中心进行遗传改造,引入全新的嵌合抗原受体(CAR),使T细胞能直接靶向并杀伤带有CD19抗原的白血病细胞。T细胞完成改造后,就会被回输到患者体内,进行治疗。 当患者体重≤50kg时,Kymriah的给药剂量基于患者体重;超过50kg时,Kymriah的给药剂量则为固定剂量。 Kymriah是在美国境内FDA批准的首款基因疗法,也是人类历史上获批的首款CAR-T疗法。因此,2017年被称为细胞免疫治疗元年。 “5年之内,所有血液肿瘤都可以通过CAR-T疗法实现治愈。”2019年腾讯科学WE大会开幕前夕,权威癌症免疫学家、美国艺术与科学院院士、Carl June接受媒体采访时如是预测。 另一方面,世界上90%的癌症都是实体肿瘤,只有10%是血液癌症。事实上,在当前的广泛研究之下,CAR-T疗法用于实体瘤的效果还不太好。 北京康爱瑞浩生物科技股份有限公司副总经理李君阳接受21新健康记者采访时表示:“将CAR-T疗法由血液瘤领域延伸到实体瘤领域,攻克难度提升很多,其中一个挑战就是如何让CAR-T细胞发现实体瘤的肿瘤细胞。” 对于大多数实体瘤而言,常见疗法是发现肿瘤相关抗原(TAA)。与血液学肿瘤相比,在实体瘤中找到理想的靶抗原更加困难。血液肿瘤——如急性淋巴细胞白血病(ALL)或慢性淋巴细胞白血病(CLL)——普遍表达B细胞标志物CD19,但实体瘤很少表达一种肿瘤特异性抗原(TSA)。 与此同时,李君阳指出:CAR-T靶向实体肿瘤抗原受到较多限制,主要原因来自于实体瘤的特殊免疫环境。 肿瘤微环境包含肿瘤细胞、基质细胞、细胞外基质以及周围组织液和脉管系统等。由于肿瘤细胞快速增殖及脉管系统的异常,常导致肿瘤微环境具有低氧、低pH值及各种细胞因子水平紊乱的特点。CAR-T细胞要真正接触到肿瘤细胞,不可能如设计时一般容易。 |
热门关键词: