|
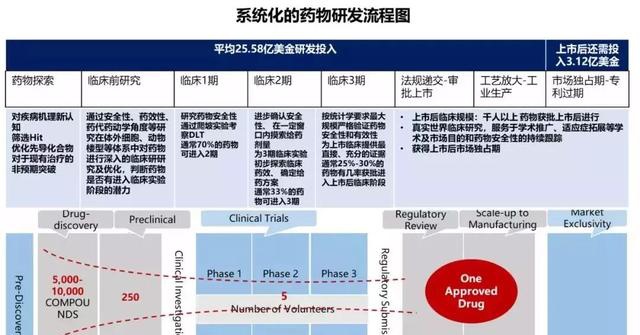
如果要说哪个行业融资能力强,生物科技类公司肯定排前列。而在生物科技类公司中,研发PD-1靶点是绝对热门领域。从如今现有PD-1上市竞争格局来看,选择大适应症作为着手点,市场更容易开拓,而选择小适应症或者罕见病,评审快研发进展会更快,也不失为一种好的策略。 从细分的选择上来看,研发单个靶向药已经成为诸多创新药企的选择,在许多企业还在扎进单抗的领域研究时,康方生物已经成为双特异性抗体的第一批“吃螃蟹者”。 在成立8年后,提前布局“2.0版本”靶向药的康方生物目前已经融资获得2.37亿美元融资,近日已经交表港交所,摩根斯坦利和JP摩根为其联席保荐机构。 关于研发抗癌药的企业数量,可能很难数的清,因为市场太大了,但市场大不代表所有参与者都能分到一杯羹。 从最开始立项开始,到临床前研究,通常在人类的历史上,医疗和制药技术的突破往往诞生在一些重大的基础医学科学理论突破、或者偶然事件后面的生物、化学、天然植物相关物质对疾病的作用。但是从二战以后的新药发现的黄金时期以来,新药发现变得越来越系统化,从药物靶点筛选,到先导化合物筛选,到病理、毒理试验,再到临床1-3期试验。 如果每一款药背后都代表一家药厂的话,到最后一步商业化,能够成功的概率大概在万分之一,需要花费的时间则是8-10年,这还不包括半路杀出个陈咬金等概率事件。
我们先看一下康方生物的研发管线多个药物开发项目,其中10个抗体处于临床研究阶段,6个双特异性抗体(两个处于临床阶段)以及4个抗体获得FDA的IND批准。 迄今为止,全球仅批准了3个双特异性抗体药物,其中2款与肿瘤适应症相关的双特异性抗体药物都涉及到了CD3靶点。有意思的是,康方生物目前并没有“围猎”CD3这个靶点,而是聚焦在PD-1、CTLA-4这些跟肿瘤免疫相关的免疫检查点上。 AK104是康方生物自主研发、拥有完全自主知识产权及全球开发权的国际首创抗PD-1/CTLA-4双特异抗体新药,是公司首个进入临床试验的品种。在国际上,2017年9月18日国际多中心临床试验在澳洲启动,2019年4月2日,获得美国食品及药物管理局(FDA)的批准。 在中国,2017年8月21日CDE开始承办IND,2018年6月8日获得临床批件。2018年11月26日,北京肿瘤医院医学伦理委员会通过院长季加孚开展的PD1/CTLA4双抗AK104治疗晚期实体瘤及联合化疗(mXELOX)一线治疗晚期或转移性G/GEJ腺癌的多中心、开放性、Ib/II期研究,2019年3月1日官宣入组第一例受试者。 但是需要注意的是,作为全球首个进入临床试验阶段PD-1/CTLA-4的双特异性抗体的康方生物,目前也面临者同业之间的追赶,从已上市的公司规划来看,已经有多家公司开始进入PD-1/CTLA-4的临床阶段,进度相差不大,最终路死谁手,还得看各家的看家本领强不强。 AK105是由康方生物自主研发的重组人源化抗 PD-1 单克隆抗体。2019年6月17日,中山康方生物医药有限公司( 康方生物 )宣布,康方生物与中国生物制药有限公司(中国生物制药)旗下的正大天晴药业集团股份有限公司( 正大天晴)签订合营合同,成立合营公司,共同开发康方生物的PD-1抗体 AK105 项目(AK105 项目)并全力推动该药物的******上市及商业化。 目前AK105项目正在中国开展包括治疗经典型霍奇金淋巴瘤(II期******性临床研究)、 转移性鼻咽癌(II期******性临床研究)、联合化疗一线治疗非鳞非小细胞肺癌(III期临床研究)、 联合化疗治疗鳞状非小细胞肺癌(III期临床研究)、联合盐酸安罗替尼治疗不可切除肝癌(II期临床研究)等适应症的若干项临床试验,未来会拓展开发更多的适应症。 康方生物上市前的融资额,还是挺多的,四轮融资2.37亿美元,约合人民币16.68亿元,融资后投后估值约为32.5亿人民币。 |
热门关键词: